¿Cuál es la metodología de rutina para que un tejido se transforme en un preparado histológico?
En este artículo se describe el proceso convencional utilizado en histología: desde la fijación del material hasta la obtención del preparado, incluyendo una breve referencia a los procedimientos en microscopía electrónica.
Fijación
La fijación es la primera etapa para lograr una adecuada preparación histológica. Su objetivo es matar las células, evitar la autólisis y preservar las estructuras en un estado lo más parecido posible al que tenían en la célula viva (Zarlavsky, 2014).
Algunos ejemplos de fijadores y soluciones fijadoras:
- FAA (formol, alcohol y ácido acético): comúnmente utilizado para tejidos vegetales.
- Formol 10 %: de uso frecuente en histología animal y anatomía patológica.
- Paraformaldehído y glutaraldehído: usados en microscopía electrónica.
El procedimiento habitual consiste en sumergir el material en el líquido fijador (fijación por inmersión).
Deshidratación y clarificación del material
Una vez finalizada la fijación, el material se somete a deshidratación para eliminar progresivamente el agua y reemplazarla por alcohol. Este proceso se realiza mediante inmersiones en alcoholes de concentración creciente hasta llegar al alcohol etílico absoluto o alcohol isopropílico.
Luego, se lleva a cabo la clarificación, en la que el alcohol es reemplazado por xileno o cloroformo, sustancias miscibles con la parafina.
Infiltración e inclusión en parafina
La infiltración consiste en permitir que la parafina líquida penetre lentamente en el tejido, reemplazando el agente aclarante. La inclusión es el paso que otorga al tejido la consistencia necesaria para poder ser cortado en micras de espesor.
Se suelen realizar dos baños de parafina a 60 °C. El último se realiza con la parafina definitiva, con la que se forma un bloque al colocar la muestra en un molde (o casete). Luego de solidificarse, el bloque se talla con forma de pirámide trunca. (Figura 1).
Ejemplos de secuencia:
(Los tiempos pueden variar según el tamaño del tejido)
- Alcohol 70 – 1 hora
- Alcohol 95 (1) – 1 hora
- Alcohol 95 (2) – 1 hora
- Alcohol 100 o isopropílico – 1 hora
- Cloroformo – 1 hora o overnight
- Parafina 1 – 1 hora
- Parafina 2 – 1 hora

Obtención de cortes
Cortes para microscopía óptica
Los cortes se realizan con un micrótomo rotatorio (tipo Minot), que posee una cuchilla de acero inoxidable. Este equipo permite obtener cortes de entre 3 y 5 micras de espesor, adecuados para su observación al microscopio. (Figura 2).
¿Por qué los cortes deben ser tan finos?
Porque durante la observación microscópica se requiere una sola capa de células, lo que permite distinguir los detalles morfológicos y evita la superposición de estructuras.

Adhesión al portaobjetos
Los cortes se colocan en un baño de flotación con agua tibia a 45 °C (aproximadamente), es decir, por debajo del punto de fusión de la parafina (54–58 °C). A esta agua se le agrega una pequeña cantidad de gelatina, lo que facilita la adhesión del corte al portaobjetos.
También pueden utilizarse portaobjetos cargados para mejorar la adherencia, especialmente en técnicas como inmunohistoquímica o impregnaciones argénticas.
Habitualmente los cortes en parafina se colocan en la estufa a 60°C por un mínimo de 30 minutos (secado), para favorecer una mejor adherencia y evitar su desprendimiento en los procedimientos posteriores.


Técnicas
Como los cortes en parafina son incoloros, se necesita realizar una técnica de coloración, histoquímica, impregnación o inmunohistoquímica, dependiendo de lo que se quiera estudiar. Pero antes, es necesario eliminar la parafina, ya que es hidrófoba.
Secuencia para deparafinar e hidratar el tejido:
- Xilol durante 15–20 minutos.
- Hidratación progresiva con alcoholes decrecientes (absoluto, 95°, 70°).
- Agua corriente y luego agua destilada.
Una vez finalizado este proceso, el tejido está listo para la técnica de interés.
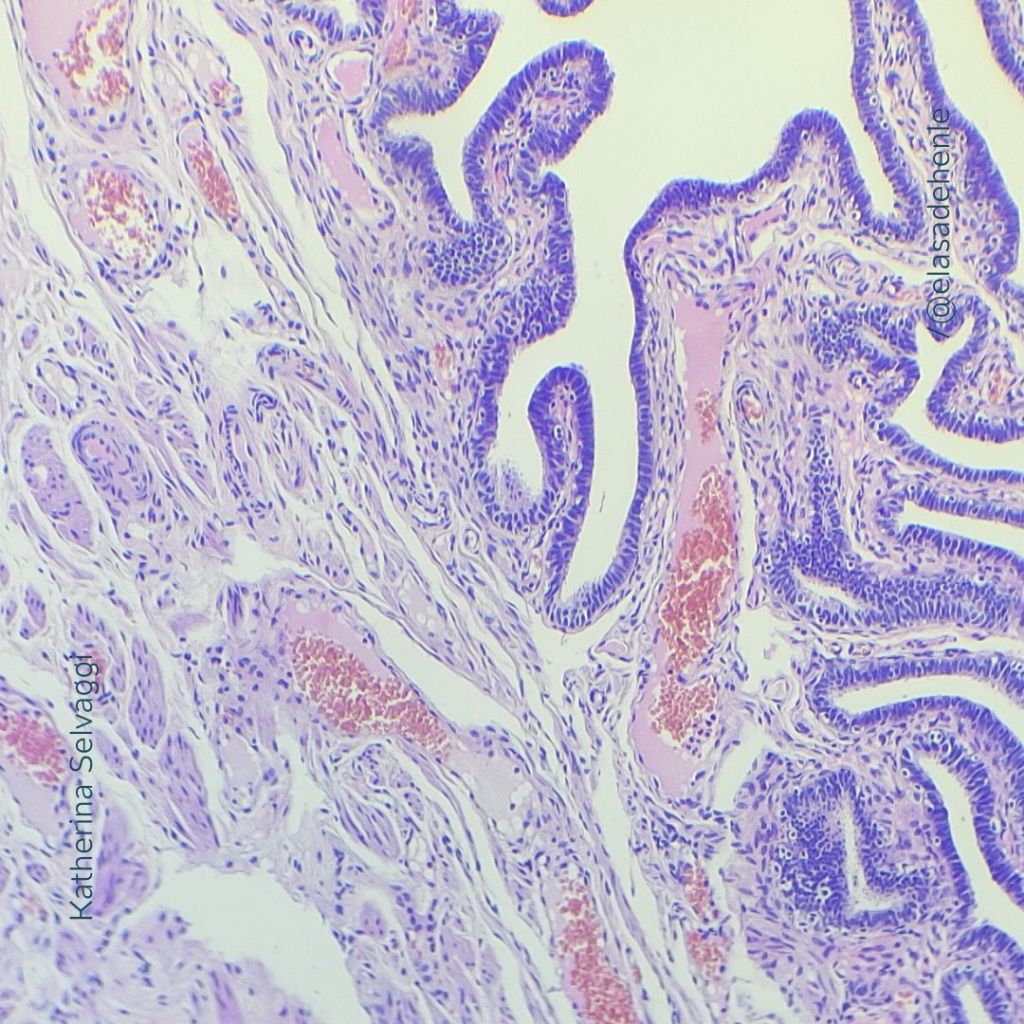
La técnica más utilizada en histología animal y anatomía patológica es la hematoxilina y eosina (H&E).
Emplea hematoxilina (catiónica), que tiñe de azul-violáceo las estructuras ácidas o aniónicas como los núcleos celulares y los ribosomas debido a que contienen grandes cantidades de ácidos nucleicos que tienen carga negativa y se unen a la hematoxilina.
Esta técnica también utiliza eosina, un colorante ácido o aniónico que tiñe de rosa las estructuras básicas o catiónicas, como los citoplasmas.
En H&E, los núcleos celulares aparecen en tonos azulados o violáceos, mientras que los citoplasmas se observan en distintas tonalidades de rosado. (Figura 5 y 6).
Si querés leer más sobre ella, podés visitar este otro artículo: ¿Hematoxilina o hemateína?
Montaje
Luego de la tinción, se realiza el deshidratado final y el montaje. Los pasos son los siguientes:
- Alcoholes crecientes (70°, 95°, absoluto).
- Xilol.
- Montaje definitivo con un medio no hidrosoluble como Bálsamo de Canadá o Entellán, y colocación del cubreobjetos.
Microscopía electrónica
El proceso de preparación para microscopía electrónica es un poco diferente ya que se utilizan otros materiales y equipos específicos.
En la microscopía electrónica de transmisión, por ejemplo, se emplean resinas epóxicas como Epon o Araldita en lugar de parafina, y los cortes son ultrafinos, de entre 40 y 70 nanómetros. Estos cortes se realizan con un ultramicrótomo, utilizando cuchillas de vidrio o diamante.

En el caso de la microscopía electrónica de barrido, el tipo de muestra y el objetivo son distintos. No se realizan cortes ultrafinos, ya que lo que se analiza es la superficie del material.

Bibliografía:
- GARCIA DEL MORAL, Raimundo. «Laboratorio de Anatomía Patológica» Interamericana-McGraw Hill, 1993
- Geneser, F., Histología. Editorial Médica Panamericana. 3° edición
- Protocolo de clases prácticas de Histología (2017) Ciclo básico clínico comunitario. Facultad de Medicina, Udelar
- Ross, M., (2007), Histología: Texto y atlas color con Biología Molecular Y Celular. Editorial Médica Panamericana
- Rosa, L (2017) Destrezas prácticas de laboratorio y comparación de técnicas histológicas.
- S.PODESTA, I.SANSON, «Introducción a las Técnicas Histopatológicas» Facultad de Medicina
- Tomasí, H. (2013). Métodos histológicos. Aspectos teórico – prácticos. Universidad Nacional de Córdoba.
- Zarlavsky, G. (2014). Histología Vegetal: Técnicas simples y complejas. Sociedad Argentina de Botánica.
Deja un comentario